-
-
2022四川高考化学冲刺试卷
本试卷分选择题和非选择题两部分。第I 卷(选择题)1 至 4 页,第II 卷(非选择题)5 至 8页,共8 页 ,满分 100 分,考试 时间 100分钟。
注意事项:
1.答题前,务必将自己的姓名、考籍号填写在答题卡规定的位置上。
2.答选择题时,必须使用 2B 铅笔将答题卡上对应题目的答案标号涂黑,如需改动 ,用橡皮擦擦干净后,再选涂其它答案标号 。
3.答非选择题时,必须使用 0.5 毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效 。
5.考试结束后 ,只将答题卡交回。
可能用到的相对原子质量:
H—1 C —1 2 N—1 4 0 - 16 Na—23 S—32 Cl—35. 5 Zn- 65 Ag- 108
第I 卷(选择题,共 40 分)
本卷选择题共 20 小题,每小题 2 分,共 40 分。每小题只有一个选项符合题目要求。
1.某试剂瓶标签上安全标志如右图,该试剂可能是

A. 乙醇 B. 烧碱 C. 硝酸钾 D. 明矾
2.化学与生活密切相关。下列叙述错误的是
A. NaClO 溶液可用来杀灭新冠病毒
B. 可用淀粉溶液来检验是否为加碘盐
C. 制造医用口罩的材料聚丙烯来自于石油化工
D. 葡萄酒可用二氧化硫作防腐剂和抗氧化剂
3.下列分析错误的是
A. 酸性: HC1O4 > H3PO4
B. 离子半径:F- > Mg2+
C. 阴离子还原性:Cl- > S2-
D. H 、N、O三种元素可形成离子化合物
4.下列离子在溶液中能大量共存的是
A Na+ 、Ca 2+、Cl- 、CO32-
B. HCO3- 、K+ 、NH4+、OH
C. Fe2+ 、H+ 、SO42-、NO3-
D. Na+ 、K+ 、CO32- 、SiO32-
5.天然橡胶的单体是异戊二烯(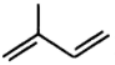 ), 下列说法正确的是
), 下列说法正确的是
A 与乙烯是同系物
B. 能发生加成聚合反应
C.常温下能与水互溶
D. 分子中所有原子共平面
6.下列反应的应用错误的是
A. 可用氧化铁与铝在高温下反应炼铁
B. 硫化钠与浓硫酸反应可制备硫化氢
C. 铁丝在氯气中燃烧可制得无三水氯化铁
D. 氧化钙与水反应可用作自热米饭加热
7.下列化学方程式中,不能准确表达其变化的是
A. 钠在空气中变暗: 2Na+ O2=Na2O2
B. 蔗糖加浓硫酸变黑:C12H22O11 ![]() 12C+ l l H2O
12C+ l l H2O
C. 漂白粉久置失效: Ca(ClO)2+ CO2 + H2O =CaCO3+2HC1O 2HC1O=2HCl十O2
D. SO2 形成酸雨:2 SO2 + O2 +2 H2O =2H2SO4
8.下列有关物质的鉴别或检验错误的是
A. 用激光笔照射区别食盐水和蛋白质溶液
B. 向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+
C. 将红色石蕊试纸伸到集气瓶口可检验瓶里是不是氨气
D. 向溶液中滴入足量稀盐酸后再滴入氯化钡溶液,可检验溶液中是否存在SO42-
9.下列实验操作正确的是
A. 配制 0. 4 mol/ L NaOH 溶液:将 4. 0 g NaOH 固体放入250 mL 容量瓶,加水至刻度线
B. 除去乙酸乙酯中的少量乙酸:加入 NaOH 溶液洗涤、分液
C. 测定氯水的 pH :将氯水滴在 pH 试纸上,然后与标准比色卡比较
D. 验证Mg(OH) 2 的溶解度比Fe( OH)3 大:向 Mg( OH) 2 悬浊液中滴入FeCl3溶液
10.下列说法正确的是
A. 升高H2SO4 稀溶液温度,溶液中c ( OH- ) 增大
B. pH = 3 的CH3COOH 溶液加入CH3COONa 固体,溶液的pH 减小
C. NaClO 稀溶液中加入 NaClO 固体,溶液中 ![]() 增大
增大
D. 向AgCl、Ag2CrO4 的饱和溶液中加入少量AgNO3 固体,溶液中![]() 不变
不变
11. 下列实验现象和结论均正确的是
A. 将石蜡油蒸气通过炽热碎瓷片后产生的气体通入酸性 KMnO4 溶液,溶液紫色褪去,说明气体中不含烷烃
B. 将铝箔在酒精灯上加热,熔化的铝不滴落,说明氧化铝的熔点比铝高
C. 将钠投入盛有无水乙醇的试管中,钠浮在液面上且有气泡冒出,说明钠密度比乙醇小
D. 将少量过氧化钠粉末加入水中,向反应后的溶液中滴入酚酞溶液,溶液保持红色,说明 反应生成了碱
12. 实验室探究从海水中提取溴的主要过程为:
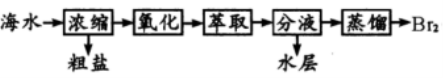 , 下列装置或操作在实验中未涉及到的是
, 下列装置或操作在实验中未涉及到的是
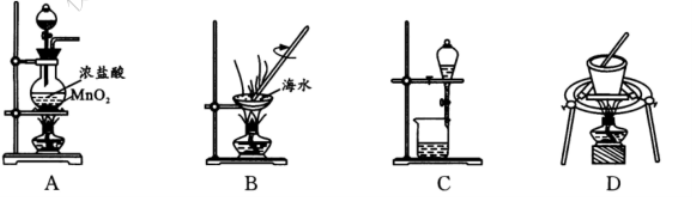
13. 设 NA 是阿伏加德罗常数的值。下列说法错误的是
A .1 L 0. 1 mol/ L NH4NO3 溶液中含有氮原子总数为 0. 2 NA
B. 7. 8 g Na2O2与水完全反应,转移的电子数为 0. 2 NA
C. 2. 8 g CO 和N2 混合气体中含有质子数为 1. 4 NA
D. 标准状况下,2. 24 L 环丙烷中化学键数目为 0. 9 NA
14. 为达到相应实验目的,下列实验设计可行的是
编号 | 实验目的 | 实验过程 |
A | 探究浓度对化学平衡移动的影响 | 向盛有 5 mL 0. 1 mol/ L K2Cr2O7溶液的试管中滴入 3 滴浓硫酸,振荡 |
B | 观察 Fe(OH)2 颜色 | 向盛有 FeSO4 溶液的试管中滴入氨水,立即振荡 |
C | 检验K+ | 用玻璃棒蘸取待测液在无色火焰上灼烧,观察现象 |
D | 探究浓度对反应速率的影响 | 向 2 支盛有 2 mL 0. 01 mol/ L H2C2O4溶液的试管中分别加入4mL 0.01mol/ L 和0. 02 mol/ L KMnO4溶液,观察现象 |
15. 实验室利用下图所示装置测定水中氢氧元素之比。下列说法错误的是
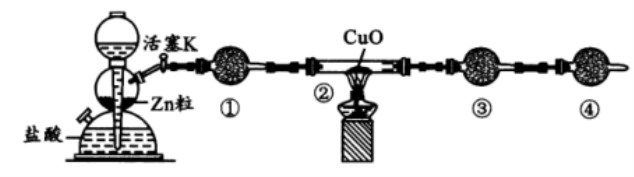
A. ①、③ 、④ 中依次盛装无水CaCl2 、碱石灰、碱石灰
B. 需测定实验前后装置②和装置③的质量差
C. 结束反应时,应先移走酒精灯,待装置②的玻璃管冷至室温,再关闭活塞 K
D. 实验后装置②的玻璃管中 CuO 未全部变红,对实验结果无影响
16. 下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
选项物质 | a | b | c |
A | Na2CO3 | NaHCO3 | CO2 |
B | NO | NO2 | HNO3 |
C | FeCl3 | FeCl2 | Fe |
D | Al2O3 | Al(OH)3 | AlC13 |
17. 锂可用于氮的固定,其转化过程如图所示。下列说法错误的是
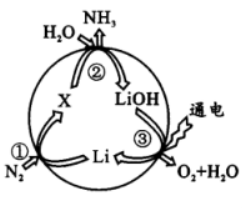
A 反应①中N2 是氧化剂
B. 反应②属于复分解反应
C. 转化过程中涉及的 H2O 、LiOH 都属于电解质
D. 反应③中 Li 在阳极生成
18. 液体锌二次电池具有电压高、成本低、安全性强和可循环使用等特点。已知:
①Zn( OH)2+2OH- =Zn( OH)42- ,②KOH 凝胶中允许离子存在、生成或迁移。下列说
法错误的是
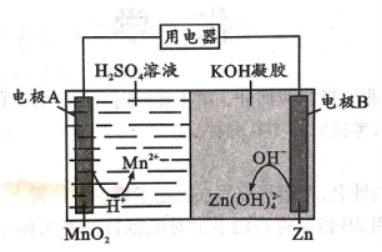
A 电池放电时,电子由电极B 经导线流向电极 A
B. 电池反应为 MnO2 +Zn + 4H + + 4OH-=Mn2+ + Zn( OH)42-+ 2H2O
C. 电池充电时,H+向电极A 移动
D. 电池充电时,电极 B的质量增大
19. 用活性炭还原氮氧化物可防止空气污染。向 1L 密闭容器加入一定量的活性炭和 NO, 某温度下发生反应:① C(s)+2NO(g) ![]() N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH
已知:②C(s) + O2(g) ![]() CO2 (g) ΔH1 = -393. 5 kJ/ mol
CO2 (g) ΔH1 = -393. 5 kJ/ mol
③N2( g ) +O2( g ) ![]() 2NO(g) ΔH2 =+180. 5 kJ/ mol
2NO(g) ΔH2 =+180. 5 kJ/ mol
下列说法错误的是
A. ΔH =-574. 0 kJ/ mol
B. 当容器内气体密度不变时,反应①达到平衡状态
C. 反应③正反应的活化能大于180. 5 kJ/ mol
D. 反应①达到平衡后,增大压强平衡向正反应方向移动
20. 室温下,用0. 10 mol/ L CH3COOH溶液滴定 10. 00 mL 浓度均为 0. 10 mol/ L NaOH 和NH3 •H2O的混合液 ,混合溶液的相对导电能力随乙酸滴入的变化曲线如下图所示。已知:Ka ( CH3COOH)=1.8 ×l0-5, K b ( NH3 •H2O )=1.8 ×l0-5 。下列叙述错误的是
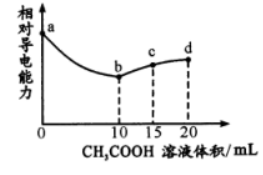
A ab 段为CH3OOH 与 NaOH 的中和过程
B. b 点水的电离程度最大
C. C 点 3c( Na+ ) = 2c(CH3COOH )+2c ( CH 3COO-)
D. d 点c( Na+)> c( NH4+)> c( OH-)> c( H+)
第I卷(非选择题,共60 分)
注意事项:
1.用黑色签字笔将答案写在答题卡规定的位置上。
2.本卷非选择题共有6 个题。
21. (10 分)R、W 、X、 Y、Z 是原子序数依次增大的短周期主族元素。R 的最外层电子数是内层电子数的两倍,X2W2 可用于呼吸面具,Y 的主族序数与周期数相等,Z 的氢化物的分子式为 H2Z。回答下列问题:
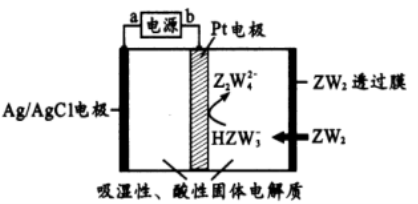
( l ) Z 在周期表中的位置是 , Y 的原子结构示意图 。
( 2) RZ2 的结构式是 ,X2Z2 的电子式是 。
(3)XYW2溶液呈 性(填“酸”、“碱”或“中”)原因是(用离子方程式表示)
。
( 4)某传感器可以检测空气中ZW2 的含量,工作原理如上图所示。则其阴极电极反应式
为 。
22. (10 分)H 是一种重要的化工原料,它可由石油和煤焦油通过下列路线合成:
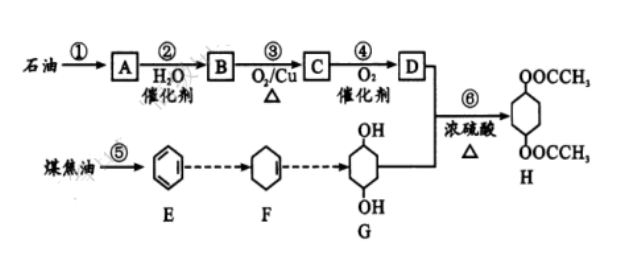
( l ) A 的名称是 ;过程①是 变化(填“物理”或“化学”,下同),过程⑤是 变化。
( 2 ) 反应③的化学方程式为 ;反应⑥的类型为 。
(3) 鉴别E与F 的方法是 。
(4) H 中六元环上的氢原子被两个氯原子取代后的有机物有 种。
23. (10 分)CO2 是一种廉价的碳资源,资源化利用 CO2 具有重要的工业与环境意义。
(1) 下列物质理论上可以作为 CO2 捕获剂的是 (填序号)。
A. NH4 Cl 溶液 B. ( NH4) 2CO3 溶液 C. 氨水 D. 稀 H2SO4
( 2 ) 以 TiO2 为催化剂的光热化学循环分解CO2 反应为碳减排提供了一个新途径。该反
应的机理及各分子化学键完全断裂时的能量变化如下图所示。
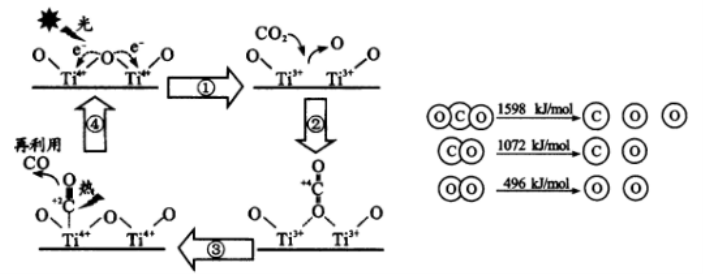
该转化过程①中会 能量(填“吸收”或“释放”);CO2 分解反应的热化学方程式为
,实现该反应的能量转化方式是 。
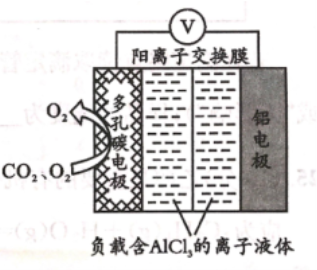
( 3)O2辅助的 Al- CO2 电池能有效利用 CO2 , 且电池反应产物Al2( C2O4) 3 是重要的化工原料,工作原理如右图所示。若正极产生O2- 将 CO2 还原生成C2O42-,则正极的反应式为 ;电路中转移 1 mol 电子,需消耗 CO2 L(标准状况)。
24. (11 分)碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
( 1) 市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验:
试剂:稀 H2SO4 、BaCl2 溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③ | ④有白色沉淀生成 |
⑤静置, | ⑥ |
( 2) 用AgNO3标准溶液滴定Cl-(以K2C rO4 溶液为指示剂,Ag2CrO4为砖红色沉淀),
来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg, 用容量瓶配制100mL 溶液,定容时,用 加蒸馏水至刻度线。
② 配制 AgNO3溶液及浓度标定:称取Ag NO3 晶体8. 5 g 于烧杯中,用 取 500 mL 水并倒入烧杯中,搅拌摇匀后,转入 色试剂瓶,置于暗处、备用。用NaCl 标准溶液标定上述 Ag NO3 溶液浓度为b mol/ L。
③滴定样品:取样品溶液20. 00 mL 于锥形瓶中,加过量稀Ag NO3 , 滴入2~3滴K2C rO4 溶液,用Ag NO3 标准溶液滴定,滴定终点的现象为 。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积 / m L | 20.00 | 21. 55 | 20.02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果 (填“偏高”、“偏低” 或“无影响”);样品的纯度为 %。
25. (10 分)乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产。气相直接合成的反应为:C2H4( g ) +H2O( g ) ![]() C2H5OH( g ) ΔH, 乙烯的平衡转化率随温度、压强的变化关系如下图[其中n ( C2H4): n ( H2 O) = l:1 ] 。
C2H5OH( g ) ΔH, 乙烯的平衡转化率随温度、压强的变化关系如下图[其中n ( C2H4): n ( H2 O) = l:1 ] 。
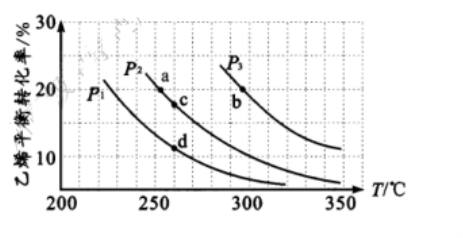
(1)p2 时,若起始n (H2O): n (C2H4) =lmol, 容器体积为 1 L, 反应经 5 min 达到a 点,在 0~5 min 时段,反应速率 v (C2H5OH ) 为 mol/(L• min), a 点的平衡常数 K a =
(保留两位小数)。
( 2)乙烯气相直接水合反应的ΔH 0 ( 填“>”或“< ”)相同起始量达到a、b 所需要的时间t a t b( 填“> ”、“<”或“= ” ,后同)。c、d 两点的平衡常数Kc Kd。
( 3 ) 300 °C时,要提高乙烯的平衡转化率可采取的措施有 、 。
26. ( 9 分)硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为 ZnO, 还含有少量 PbO、CuO、Fe2O3 、Fe O等)生产 ZnSO4• 7H2O的流程如下:
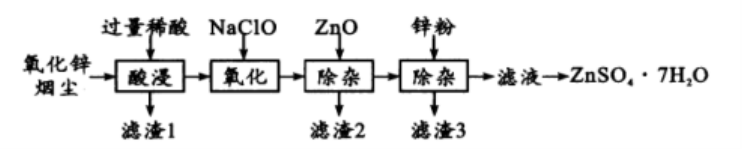
有关金属离子[ c( Mn+)=0.1 m o l / L ] 形 成 氢氧化物沉淀的 pH 范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | C u2+ |
开始沉淀的 pH | 1.5 | 6. 3 | 6.2 | 4. 7 |
沉淀完全的 pH | 2.8 | 8. 3 | 8.2 | 6. 7 |
(1) “酸浸”时用的稀酸是 ;滤渣1 主要成分是 。
( 2) “氧化”时的 离子方程式为 ;加入ZnO除杂时溶液的pH 控制范围是 ~5.0。
( 3 ) 滤渣3含有锌和 ;滤液得到 ZnSO4•7H2O的操作是 、洗涤、干燥。
( 4)取14. 35 g ZnSO4•7H2O 加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8.05 | 6. 72 | 4.05 |
则 680°C时剩余固体的化学式为 (填序号) 。
A.ZnO B. Zn3O( SO4)2 C. ZnSO4 D. ZnSO4•H2O
·1·