-
-
2022年天津高考化学冲刺试卷及答案解析
第一卷 (选择题 共36分)
一、选择题(本题包括6小题,每题6分,共36分。每小题只有一个选项符合题意)
1.化学与生活、社会密切相关,下列说法正确的是 ( )
A.维生素在天然食品中含量丰富,所以加工后的食品中维生素含量也高
B.2M+N=2P +2Q ,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求
C.世界卫生组织建议每天钠的摄取量少于2000 mg, 人们每天可摄取少于2 000 mg的金属钠
D.人体缺铁会得甲状腺肿大疾病
2.被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH),下列说法正确的是 ( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0. 1 mol Zn完全溶解时,转移电子个数为1.204 ×1024
D.电池正极反应式为:2MnO2 +2e-十2H2O=2MnO(OH)+2OH-
3.已知25℃,AgI饱和溶液中,C(Ag+)=1.22![]() 10-8mol/L,AgCl饱和溶液中,C(Ag+)=1.25
10-8mol/L,AgCl饱和溶液中,C(Ag+)=1.25![]() 10-5mol/L,若在5ml含有KCl和
10-5mol/L,若在5ml含有KCl和![]() 各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是 ( )
各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是 ( )
A.C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-)
B.C(K+)>C(NO3-)>C(Ag+)> (Cl-)>(I-)
C.C(NO3-)>(K+)> C(Ag+)> (Cl-)>(I-)
D.(K+)> C(NO3-)>C(Ag+)=(Cl-)+(I-)
4.某短周期元素的最高价氧化物所对应的水化物的化学式为HxROy,气态氢化物的化学式为HzR(或RHz)。已知1molHxROy比1molHzR质量多64g,下列说法不正确的是( )
A.2y-x+z=8 B.y=4
C.R一定是硫元素 D.R一定处于第三周期
5.下列反应的离子方程式正确的是 ( )
A.少量二氧化硫气体通入到漂白粉溶液中:
Ca2++2 CIO-+SO2+H2O=CaSO3↓+2 HCIO
B.碳酸钠的水解:CO32- +2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.少量的钠投入足量的水中:Na+ 2 H2 O =Na++2OH-+H2↑
D.向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
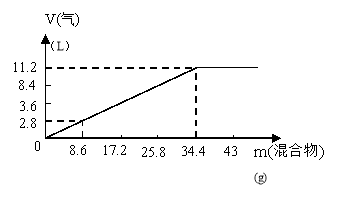 6.在100mL NaOH溶液中加入
6.在100mL NaOH溶液中加入![]() 和
和
(NH4)2SO4固体混合物,加热充分反应,加入
的混合物的质量和产生的气体的体积(标准
状况)关系如图。当V(NaOH)=140mL时,固
体混合物的质量是51.6g,充分反应后,生成
气体的体积是(标准状况) ( )
A.7.84L B.8.4L C.15.68L D.16.8L
第二卷 (填空题 共64分)
7.A、B、C、D、E、F是元素周期表中连续三个短周期的元素,且原子序数依次增大。A与D同主族,B、C同周期且相邻,C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与F的最外层电子数相等,E的简单离子为同周期中离子半径最小的。
回答下列问题:
(1)A与B形成的一种液态化合物M与C的一种单质的摩尔质量相等,则M的化学式为
(2)A和C形成的一种具有氧化性的液态化合物N与M恰好完全反应,产生两种无毒又不污染环境的物质X和Y。已知:1molM与氧气反应生成X和Y放出的热量为Q1kJ,N生成1 molC单质吸收的热量为Q2kJ。请写出常温常压下M与N反应的热化学方程式
(3)A与B形成的另一种气态化合物Z,写出实验室制取Z的化学方程式
(4)C与D按原子个数比1:1所形成的化合物的电子式
(5)六种元素中其中三种元素组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因
(6)E的单质与D的最高价氧化物的水化物反应的化学方程式
(7)A单质与C的单质组成新型燃料电池,写出以KOH为电解质溶液的负极反应式
8.分子式为C12H14O2的F有机物广泛用于香精的调香剂。
为了合成该物,某实验室的科技人员设计了下列合成路线:
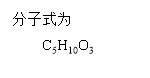
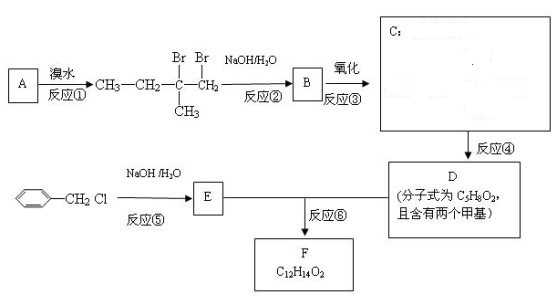
试回答下列问题:
![]() (1)按系统命名法给A物质命名 ;A物质在核磁共振氢谱中能呈现 种峰,其强度之比为 ;与A具有相同官能团的同分异构体(含有顺反异构体、含A)有 种;
(1)按系统命名法给A物质命名 ;A物质在核磁共振氢谱中能呈现 种峰,其强度之比为 ;与A具有相同官能团的同分异构体(含有顺反异构体、含A)有 种;
(2)C物质的官能团名称______;E物质的结构简式___________;
(3)上述合成路线中属于取代反应的是 (填编号);
(4)反应④的化学方程式为 ;
(5)写出E属于芳香族化合物同分异构体(不含E)的结构简式:
。
9.某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和 HCl挥发出来 , 同时证明氯气的某些性质 , 甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略 ) , 按要求回答问题。
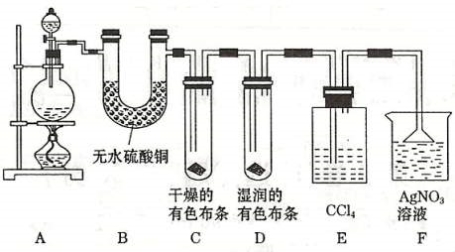

(1)下列方法中 , 可制得氯气的正确组合是 。
(已知酸性条件下,K2Cr207、、KClO3的氧化性均强于Cl2;酒精灯可以不用)
① MnO2 和浓盐酸混合共热 ; ②次氯酸钠和浓盐酸混合 ;
③K2Cr207 和浓盐酸混合 ; ④KClO3 和浓盐酸混合共热;
⑤KMn04和浓盐酸混合;
A.只有① B.只有①⑤
C.只有①③④⑤ D.全部可以
(2)若用含有 0.2 mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2, 制得的Cl2 体积(标准状况下)总是小于1.12 L的原因是 。
(3)①装置 B 的作用 , 现象是 。
②装置 C 和 D 出现的不同现象说明的问题是 。
③装置 E 的作用是 。
④写出装置 F 中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷 , 不能确保最终通入 AgNO3 溶液中的气体只有一种。为了确保实验结论的可靠性 , 证明最终通入 AgNO3 溶液的气体只有一种 , 乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间 ( 填装置字母序号 ) , 装置中应放入 。
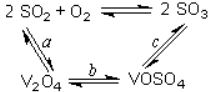 10.(1)二氧化硫的催化氧化的过程如图所示,
10.(1)二氧化硫的催化氧化的过程如图所示,
其中a、c二步的化学方程式可表示为:
SO2+V2O5![]() SO3+ V2O4
SO3+ V2O4
4VOSO4+O2![]() 2V2O5+4SO3。
2V2O5+4SO3。
 该反应的催化剂是 (写化学式)
该反应的催化剂是 (写化学式)
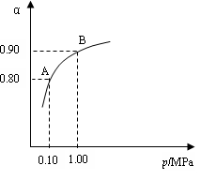
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与
体系总压强(p)的关系如右图所示。将2.0 mol SO2
和1.0 mol O2置于5 L密闭容器中,反应达平衡后,
体系总压强为0.10 M Pa。试计算反应
2SO3![]() 2SO2+O2 在550 ℃时的平衡常数
2SO2+O2 在550 ℃时的平衡常数
K= 。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2![]() 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
试填写下列空格:
 A容器达到平衡时所需的时间比B容器__ _(填:“短
A容器达到平衡时所需的时间比B容器__ _(填:“短
或长”);平衡时A容器中SO2的转化率比B容器_______(填:
“大或小”);达到所述平衡后,若向两容器中通入等物质的量的
原反应气体,达到平衡时,A容器的混合气体中SO3的体积分
数_________(填“增大”、“减小”或“不变”,下同);B容器的
混合气体中SO3的体积分数_________。
参考答案
1—6 BDACDC(每个6分)
7.(15分)(1)N2H4(2分)
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)H=-(Q1—Q2)kJ mol(3分)
![]()
(3)2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O(2分)
(4)4Na+[OO]2-Na+(2分)
![]() (5)ClO-+H2O HClO+OH-(2分)
(5)ClO-+H2O HClO+OH-(2分)
(6)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
(7)H2—2e-+2OH-=2H2O(2分)
8.(19分)(1)2—甲基—1—丁烯(1分);4(2分)
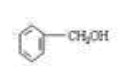 3:3:2:2(2分);6(2分)
3:3:2:2(2分);6(2分)
(2)羟基、羧基(2分);
 (3)②⑤⑥(2分) (2分)
(3)②⑤⑥(2分) (2分)
(4)

(5)
(每空1分)
9.(16分)(1)D(2分)
(2)①随着反应的进行,盐酸浓度减小,将不再反应。(1分)
②加热浓盐酸挥发(1分)
(3)①证明有水蒸汽生成(1分),白色变蓝色(1分)
②干燥的氯气无漂白性,次氯酸有漂白性(2分)
③吸收氯气(2分)
④Ag++Cl-=AgCl↓(2分)
(4)E(1分)F(1分)湿润的淀粉碘化钾试纸或湿润的有色布条(2分)
10.(14分)(1)V2O5(2分) (2)2.5×10-3mol·L-1(2分)
(3)CD(2分)
(4)短……(2分);大……(2分); 不变……(2分),增大……(2分)