-
-
物质的量
友情提醒:由于高三网站宽度限制,上传文本可能存在页面排版较乱的情况,如果点击下载或全屏查看效果更佳。
本知识点是化学计量的基础,也是化学的基础语言之一,主要内容包含:物质的量及其单位,摩尔质量,阿伏加德罗常数,气体摩尔体积,阿伏伽德罗定律的内容及其推论。这些内容在高考中考查“阿伏伽德罗定律的内容及其推论”的难度较大,是本节的难点,在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子数。这一规律称为阿伏加德罗定律。
误区提醒
1、阿伏加德罗定律只适用气体,对固体、液体物质不适用。
2、只有温度、压强、体积都相同的气体,其分子数才相同。
3、气体摩尔体积是阿伏加德罗定律的具体体现。
4、使用摩尔作单位时,应该用化学式符号指明粒子种类,而不能用名称。否则,概念模糊,意义不清。
一、知识网络:
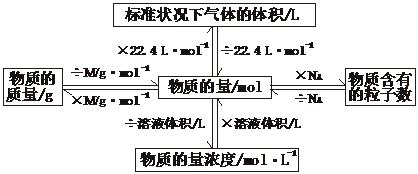
二、基本公式:
(1) 物质的量与微粒个数的关系: n=![]()
(2) 物质的量与质量的关系: n=![]() M=
M=![]() m=M·n
m=M·n
(3) 气体物质的量与体积的关系:n=![]() n=
n=![]() (标准状况) Vm =
(标准状况) Vm = ![]() V=
V=![]()
(4) 物质的量浓度:c=![]() n=c·V
n=c·V
(5) 溶液物质的量浓度与质量分数的关系: c =![]() (密度的单位:g/cm3 ) n=
(密度的单位:g/cm3 ) n=![]()
(6) 溶液稀释: c1V1=c2V2
三、物质的量的相关知识和概念:
1、物质的量:是表示大量粒子集体的一个物理量,符号为n,单位是摩尔(mol)。
2、摩尔:是物质的量的单位;
国际上规定, 1摩尔粒子集体所含的粒子数与0.012 kg C中所含的碳原子数相同,约为6.02×1023
3、阿伏加德罗常数:1摩尔的任何粒子的粒子数,即1摩尔粒子数的准确值,用符号NA表示,NA的近似值为6.02×1023mol-1。
计算公式:n=![]()
4、使用摩尔这个单位时要注意:①使用范围,只能用于微观(原子、离子等),不适用于宏观
②使用时应该用化学式指明粒子的种类,而不使用该粒子的中文名称。
5、物质的量与物质质量的关系:
1任何粒子或物质的质量以克为单位,其数值都与该粒子的相对原子质量或相对分子质量相等。
6、摩尔质量:单位物质的量的物质所具有的质量叫做~ ,用符号M表示,单位是g.mol-1。
计算公式:M=![]()
注意:摩尔质量与相对分子质量、相对原子质量的关系:摩尔质量以g•mol-1为单位,数值上与相对分子质量或相对原子质量相等,相对原子质量或相对分子质量无单位。
7、气体摩尔体积:单位物质的量的气体所具有的体积叫做~ ,用符号Vm表示,单位是L.mol-1。
计算公式:Vm = ![]() 此概念要具备的要点:①必须是气体(可以是混合气体)②要看气体的状况
此概念要具备的要点:①必须是气体(可以是混合气体)②要看气体的状况
例如:①气体(可以是混合气体)②在标准状况下 ③物质的量为1mol ④则体积约为22.4L。
如果是气体但不在标准状况下,物质的量即使是1mol,体积也不等于22.4L。
8、阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的分子。(T、p恒定时:V1/V2=n1/n2=N1/N2)
9、阿伏加德罗定律推论: PV=nRT
(1)T、p恒定时:V1/V2=n1/n2=N1/N2 (2)T、p恒定时:ρ1/ρ2=M1/M2
(3)T、p、V恒定时:m1/m2=M1/M2 (4)T、p、m恒定时:V1/V2=M2/M1
(5)T、V恒定时:p1/p2=n1/n2=N1/N2 (6)T、V、m恒定时:p1/p2=M2/M1
10、决定物质体积的三因素:
(1)微粒(分子)的数目;(2)微粒(分子)本身的大小;(3)微粒与微粒之间的距离。
A、对于固体和液体,由于他们的分子是紧密堆积的,所以他们分子之间的距离视为零。
决定固体和液体体积的因素:微粒的数目和微粒本身的大小
B、对于气体,分子之间的距离很远,分子的直径(本身的大小)与分子之间的距离比起来是很小很小的,所以分子的直径(本身的大小)可视为零。
决定气体体积的因素:微粒的数目和微粒之间的距离
11、物质的量浓度:表示单位体积溶液里所含溶质B的物质的量。符号cB ,单位: mol•L-1
12、溶液的稀释:溶液稀释的总原则:溶质的量不变
对于质量分数的溶液:溶质的质量不变,m1W1==m2W2
对于物质的量溶液:溶质的物质的量不变,c1V1==c2V2
13、物质的量浓度c与质量分数W之间的关系:c ==1000ρW/M (密度的单位:g/cm3 )
14、一定物质的量浓度溶液的配制:容量瓶
(1)步骤:计算、称量(量取)、溶解、冷却、移液、洗涤、定容、摇匀、装入试剂瓶备用。
(2)误差分析:A、仰视、俯视 B、未冷却
15、气体的温度、压强、体积、质量、摩尔质量之间存在以下关系:
理想气体状态方程,由此可推知以下重要推论:
(1)同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比。
(2)同温同压下,任何气体的体积比等于它们的物质的量之比。
(3)同温同压下,相同质量的任何气体的体积比等于它们的相对分子质量的反比。
(4)同温同压下,任何气体的密度比等于它们的相对分子质量之比。
(5)同温同容下,气体的压强比等于它们的物质的量之比。
关于更多2016年高考化学复习中物质的量知识专题请查看<<<高中化学频道>>>(http://www.gaosan.com/gaozhonghuaxue/),高中化学频道2016年高考生及家长提供高中化学基础知识、学习方法以及高考化学答题技巧等,欢迎访问高三网,高考生的专属网站。